编者按
非编码核糖核酸(以下简称非编码RNA)在生命活动调控的各个方面发挥着重要作用。研究非编码RNA对了解生命调控的本质不可或缺,是当前生命科学研究前沿热点。
2014年,国家自然科学基金重大研究计划“基因信息传递过程中非编码RNA的调控作用机制”(以下简称重大研究计划)正式启动。重大研究计划使用多学科交叉的综合手段,解密非编码RNA的新规律和新机制。经过8年探索,科学家推动我国非编码RNA研究进入国际领先行列,实现了跨越式发展。
 陈润生作学术报告。
陈润生作学术报告。在人类遗传信息传递过程中,非编码RNA不参与编码蛋白质,占全部RNA的98%,如同宇宙中神秘的“暗物质”,是生命活动调控的“幕后推手”。
2014年起,中国科学家发起重大研究计划,并于2023年底完成结束评估。
在重大研究计划支持下,科学家通过8年不懈努力,在新型非编码RNA的发现、调控机制和功能解析,以及前沿方法与技术开发等方面取得了一系列重大成果,使我国非编码RNA研究领域得到了跨越式发展,初步确立了我国在非编码RNA研究领域的国际领先地位。
瞄准未知的98%
从脱氧核糖核酸(DNA)到RNA再到蛋白质,遗传学的“中心法则”用3种物质精准而简洁地描述了遗传信息传递过程。这是所有生命活动调控的基础。
随着科学研究的不断深入,科学家发现了新问题。“中心法则”描述的DNA、RNA、蛋白质这3种物质在数量上并没有和预期的一致。人的蛋白质编码基因大约有2万个,但蛋白质的种类却超过5万个;在所有的RNA中,98%都是没有编码蛋白质的非编码RNA。新问题引发了新思考:这些不参与编码的RNA,到底发挥了什么作用?
2012年前后,作为国内著名的生物信息学研究者,中国科学院院士、中国科学院生物物理研究所研究员陈润生发现,越来越多的研究表明,这些非编码RNA在生命活动调控的各个方面发挥着重要作用。
曾参加过“人类基因组计划”的陈润生大受启发。他坚信:“研究非编码RNA对了解生命调控的本质不可或缺,这个领域不仅重大,也是生命科学研究的前沿热点。国际上相关研究刚刚起步,中国科学家一定有机会走在前面!”
于是,他萌生了提出国家自然科学基金重大研究计划的想法。“该计划支持某一个领域方向,持续时间长,有利于科研人员厚积薄发产出重大成果。”陈润生告诉《中国科学报》。
作为国家资助基础研究的主渠道,国家自然科学基金委员会(以下简称自然科学基金委)同样关注这一重大、前沿领域。在自然科学基金委的组织下,陈润生自2012年提出重大研究计划申请以来,历经了一年半的多轮答辩,最终立项。
作为一位资深科学家,陈润生见过不少大场面,但面对重大研究计划立项的层层遴选,心理压力还是相当大。“遴选十分严格,从学部内部到学部层面、再到委务会,每场答辩都是差额的,都要非常认真地准备,一不小心就会被淘汰。”他说。
同时,答辩中专家的提问促使陈润生深入思考,以不断完善科学研究的目标任务。
2014年,陈润生任专家组组长的重大研究计划突出重围,获得立项。
经过深入讨论,专家组凝练出重大研究计划核心科学问题的4个方向,包括与遗传信息传递过程相关的非编码RNA,特别是长非编码RNA基因的鉴定与功能解析;与遗传信息传递相关的非编码RNA的生成、加工、修饰及代谢机制;非编码RNA与其他生物分子的相互作用、调控网络及其结构基础;非编码RNA研究的新方法和新技术。
“我们期待,在重大研究计划支持下,中国科研人员能够努力推动我国非编码RNA研究进入国际领先行列,占领这一科技制高点。”陈润生说。
“硬币两面”助力“领跑”
2023年12月,重大研究计划顺利完成结束评估。在重大研究计划支持的8年时间里,中国科研人员实现了当初的愿景。“今天,我们可以自信地说,中国非编码RNA研究走上了国际舞台,既产生了重要的基础研究成果,也培养了一大批人才。”陈润生表示。
发表论文的质量和数量是评价基础研究的重要方式之一。在重大研究计划支持下,科研人员发表了大量具有国际影响力的高水平论文,包括科学引文索引(SCI)收录的论文1000余篇,其中超过500篇论文所发期刊的影响因子大于10,在《细胞》《自然》《科学》等正刊发表论文27篇。
在业内专家看来,发表论文数量多的同时,其报道的科研成果回答了非编码RNA研究中的重大科学问题,全面提升了我国非编码RNA的研究水平,标志着我国在这一领域实现了跨越式发展。
科研人员发现了许多新的非编码RNA,其中包括os-piRNA、SPA lncRNA、risiRNA、bktRNA等4类新型非编码RNA,以及内含子自连型、内含子套索型、外显子—内含子连接型等3种新亚型环形RNA。同时,科研人员还通过一系列研究揭示了它们生成、代谢与行使功能的多种重要分子机制。
“我们不仅是孤立地发现了一些非编码RNA,还把这些新发现的RNA归成不同类别,使原创成果由‘点’构成了‘面’。”陈润生说,“这是系统而深入的工作。”
此外,科研人员创建了非编码RNA研究急需的新技术与新方法。据了解,此前诸如“RNA互作组学”“RNA修饰研究”等研究领域都因为缺乏国产技术,只能采用国外研发的技术方法,限制了国内研究水平的提高。
在重大研究计划支持下,科研人员创建了15种RNA和蛋白质互作研究新技术以及17种RNA修饰研究新技术。这些原创性技术突破为深入解析非编码RNA的结构、修饰和功能奠定了方法学基础,其中多项技术解决了领域瓶颈问题,达到了国际领跑水平。
“工欲善其事,必先利其器”,正是这些新技术的发展大力推动了非编码RNA的原创研究进程。原创技术与原创成果二者相辅相成、缺一不可,成为重大研究计划收获的“硬币两面”。
面向国家重大需求进行顶层设计
科研人员为进一步利用非编码RNA治疗疾病和提高农业生产开展了探索,面向国家重大需求,为保障我国的国民健康和粮食安全奠定了基础。
这些成果的取得离不开专家组在重大研究计划启动之初进行的顶层设计。
陈润生介绍:“非编码RNA关系到生命奥秘,基础研究中一定会产生重要的应用,所以我们通过专家组的顶层设计,面向国家重大需求,特别安排了基础研究在医学和农业这两个方面的应用探索。”
在医学方面,科学家通过建立一套整合组学策略,发现了多个参与调控不同生物学过程的肝癌相关非编码RNA。特别是科学家发现了新的基于血清的微小RNA的肝癌标志物。
这项研究成果引发了国际同行的高度关注。“这项工作开启了微小RNA作为肝癌监测标志物研究的大门。”国际肝癌临床诊疗指南编者亚历杭德罗·福纳评价。
更令专家组感到欣慰的是,2022年,这一基础研究成果成功实现技术转让,在临床上开展应用推广,主要用于肝癌、小肝癌、早期肝癌、甲胎蛋白(AFP)阴性肝癌的早期诊断。
在农业方面,科学家揭示了非编码RNA调控水稻光敏不育和生长发育的关键作用。
重大研究计划启动之初,专家组主动出击,与我国作物遗传育种领域的知名学者、中国科学院院士张启发进行深入交流。当年,在攻克水稻不育难题时,张启发发现了一个令人费解的现象:水稻中的雄性育性受光照调控,其在长日照条件下是雄性不育,但是在短日照条件下可育。其背后的科学原理是什么?
非编码RNA为张启发探索这个问题提供了新思路。科研团队开始在非编码RNA中寻找答案,最终发现,决定水稻光敏感雄性不育的关键因素是长非编码RNA——PMS1T,其点突变即可导致水稻光敏不育。这项发现解决了困扰水稻育种学科30多年的关键科学问题。
专家组的顶层设计还充分考虑了学科交叉的重要性。重大研究计划启动之初,专家组成员一致认为,非编码RNA研究从基础科学问题的设计到技术方法的改进,离不开化学学科的支撑。为此,陈润生找到致力于核酸化学生物学研究的武汉大学化学与分子科学学院教授周翔,邀请他加入该重大研究计划的专家组。
“从专家组成员的学科背景就开始‘交叉’,保证了后续开展科学研究学科交叉的连贯性。”陈润生表示。
为建制化基础研究提供经验
回顾该重大研究计划实施的8年,陈润生认为,中国非编码RNA研究之所以能够取得重要原创性成果,离不开国家自然科学基金为基础研究提供的肥沃“土壤”。
“重大研究计划就是这片‘土壤’,其中聚集了资源和人才两个关键因素,‘鼓励’和‘竞争’是两个关键词。”陈润生表示。
在项目科学家们看来,持续8年的体量足够大的经费资源支持,鼓励了研究者专心致学。同时,重大研究计划聚集了从事非编码RNA研究的年轻人,互相切磋、启发,产生新的思想火花。
一批优秀青年科研人员在重大研究计划中成长起来。中国科学院生物物理研究所研究员薛愿超便是其中之一。“2015年,我全职回国后拿到的第一笔经费就是重大研究计划的培育项目经费,后来陆续获得了重大研究计划重点项目和集成项目的支持。正是有了这些项目的持续资助,我们才能静下心来,敢于挑战高风险的课题,以解决非编码RNA领域的一些根本性难题及突破瓶颈为己任。”薛愿超表示。
陈润生高兴地看到,国内从事非编码RNA研究的队伍在不断壮大。“从每年组织的一到两次的学术会议就可以看出来,一开始只有五六十人参加,到后来有上千人参与。”他说。
同时,专家组在整体布局时重点考虑了项目的“竞争”特点。在培育阶段,所有项目的申请都是差额产生,由评审专家进行择优选取。随着重大研究计划的展开,申请人数增加,竞争越来越激烈,淘汰率也逐渐上升。
总之,专家组以宏观视角策划大方向的同时,也严把项目质量关,鼓励项目科学家围绕具体科学问题充分探索,形成一种既有设计又具有灵活性的模式。
对此,专家组认为,重大研究计划的组织形式为建制化地开展自由探索类基础研究提供了实践经验。
环形RNA:从“无名之辈”到“明日之星”
动植物体内存在种类繁多的环形核糖核酸(circular RNA),其中以反向剪接产生的环形RNA含量最为丰富,因其具有独特的闭环结构,近期引发全世界科学家的关注。
在重大研究计划支持下,中国科学院分子细胞科学卓越创新中心的科研团队对多种环形RNA的生成代谢及生物学功能进行了深入探究。
这些工作通过系统阐明环形RNA加工、折叠和降解特性,将环形RNA的生成与作用机制耦联,揭示了其全新功能,并探索了与自身免疫疾病的关联。
一系列研究成果不仅达到了国际领先水平,还助力环形RNA从“无名之辈”成为医疗技术领域的“明日之星”。环形RNA的结构使它们在细胞内更加稳定,不易被核酸酶降解,在未来医疗技术发展中展现出巨大应用潜力。
科研团队首先创建了多种先进的工具和技术用于研究环形RNA的生物学功能,包括环形RNA开源工具包CIRCexplorer和功能性环形RNA筛选新体系CRISPR-RfxCas13d系统。这些技术的开发极大拓展了研究人员对环形RNA多样环化模式和生物学功能的认识。
为揭示环形RNA的生成规律,科研团队通过创建“新生环形RNA捕获体系”,发现环形RNA生成缓慢,但可以稳定累积,且部分环形RNA达到较高表达水平。其中,一种被称为RNaseH1的酶能够分解某些环形RNA,这些特定的RNA形成了“R-loops”。这一结构如同细胞内的“小结”,不仅稳定了环形RNA本身,还能够促进其“母本”基因的转录,促使更多的RNA被生产出来。
在重大研究计划支持下,科研人员首次揭示环形RNA的生成在天然免疫中受限,为环形RNA如何参与天然免疫调控的研究开辟了新方向。基于这一认识,科研团队围绕环形RNA在天然免疫中的功能开展了一系列原创性研究。其中,包括创建环形RNA折叠研究新体系,揭示其具有特殊结构,抑制天然免疫因子PKR等活化;揭示其在病毒感染中快速降解释放PKR参与免疫调控;首次提出环形RNA适配体,有望用于治疗PKR过度激活引起的炎症性疾病,如牛皮癣、阿尔茨海默病等。
这些系统工作填补了环形RNA生成代谢和作用机制研究的空白,获得国际同行高度评价。国际专家认为,这些研究“出乎意料地揭示了环形RNA与天然免疫调控的关联”“令人信服地证明环形RNA抑制天然免疫”“提示环形RNA可作为治疗策略”等。相关成果获“上海市自然科学奖一等奖”,并实现专利转化。
总之,一系列关于环形RNA的科研进展不仅为学界带来了创新性理论认知,也为其潜在临床应用提供了重要技术指导。
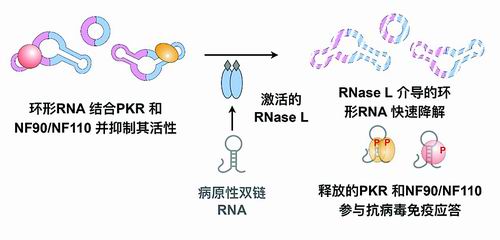 环形RNA结合PKR并抑制其活性。
环形RNA结合PKR并抑制其活性。“小蝌蚪”成长之路上的RNA
近20年来,我国不孕不育人群比例急剧增加,其中近40%为男性因素所致。男性不育已成为人口健康的重大问题,但一半以上患者的发病原因不明。
近年来,在重大研究计划支持下,中国科学院分子细胞科学卓越创新中心研究员刘默芳带领科研团队,面向国际前沿和人口健康,针对精子发生的重大生物学问题和男性不育的临床问题,围绕RNA调控在精子发生及男性不育中的新功能机制进行长期攻坚,获得了系列重大原创研究成果。
精子发生即精子的生成过程极其复杂,有许多未解之谜,涉及细胞在减数分裂时脱氧核糖核酸(DNA)的重新组合,以及为适应游动而缩小精细胞体积等一系列挑战。特别是在“减负和瘦身”过程中,精子细胞中的基因组转录活动将逐渐减少直至完全停止。为应对这个变化,精子细胞会在发育早期大量制造信使核糖核酸(mRNA)并以“惰性态”保存起来,以便在特定发育阶段“复活”并用于蛋白质合成,以支持精子形成。
然而,储存在精子细胞中的mRNA是如何开始工作的?精子形成之前,为“减负和瘦身”,胞质中大量的mRNA是怎样被清除的?细胞核压缩是如何触发的?这些问题长期困扰着该领域的科学家。
为此,科研团队建立了慢病毒小鼠睾丸转导和高纯度精子细胞级分等独特的研究系统和方法,长期致力于RNA调控在精子发生中的功能机制研究,最终率先发现生殖细胞特异性PIWI蛋白及其结合的piRNA,可以通过结合不同的蛋白质因子,双向调控蛋白质编码基因的表达。
研究还发现RNA结合蛋白FXR1通过相分离激活后期精子细胞mRNA翻译,系统地解答了精子细胞中“惰性态”mRNA如何被激活、精子成熟前如何清除mRNA等精子形成中的两个重大科学问题。
科研团队在关注精子发生基础生物学问题的同时,探讨了男性不育新病因及其致病机制。通过筛查男性不育患者样本并结合动物模型,发现PIWI在精子细胞降解调控异常可致男性不育,首次证明了人类piRNA通路基因突变可能引发男性不育,并基于对致病机理的了解,设计了针对此类不育症的诊断方法和潜在治疗方法,获国家发明专利授权。
近期,科研团队又鉴定出致男性不育的piRNA通路基因新突变,为男性不育的精准医疗提供了理论基础和新策略。
上述系列研究工作不仅有助于解答精子发生中的关键科学问题,还揭示了男性不育的新病因及致病机制,为相关男性不育症的诊断和治疗提供了新的理论基础和方法策略。
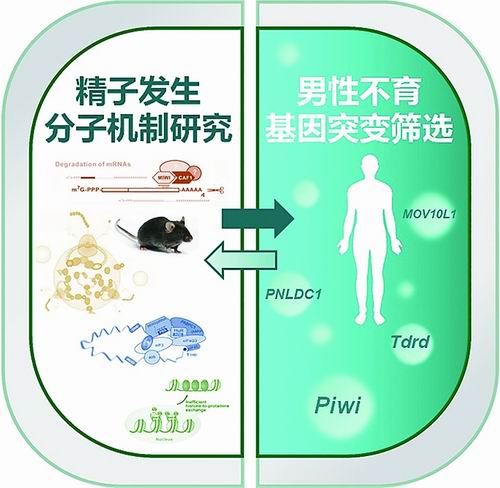 研究示意图。
研究示意图。“看”得更清!RNA结构解析新技术孕育新发现
“结构决定功能”是物质科学界的基本共识。目前,非编码RNA的结构解析难题是开展其调控功能和作用机制研究的一大瓶颈。
与编码蛋白质的信使RNA(mRNA)不同,非编码RNA往往需要先形成二级结构,并在RNA结合蛋白的帮助下折叠成更为复杂的高级结构,进而与其他RNA分子相互作用以发挥生物学调控功能。因此,解析非编码RNA的结构和作用靶标是理解其功能机制的关键。
面对这一挑战,在重大研究计划支持下,中国科学院生物物理研究所研究员薛愿超带领的科研团队在RNA结构解析及RNA-蛋白质相互作用等方面取得了多项重要成果。
科研团队创建了RNA原位构象测序技术“RIC-seq”。以该技术为主要手段,他们首次全景式解析了非编码RNA的二级结构、作用靶标和高级结构。该原创技术获得了国家发明专利,并已成功进行成果转化。在此基础上,该团队还发展了capture RIC-seq、vRIC-seq等一系列新技术和新方法,用于解析特定RNA结合蛋白所介导的RNA构象。
新技术会带来新发现和新理论。科研团队利用创建的RIC-seq技术,首次发现DNA上可与蛋白质结合的“增强子”和“启动子”区域产生的非编码RNA相互作用,并利用这样的相互作用准确识别出哪一个“增强子”调节哪一个“启动子”。
同时,实验还发现,增强子-启动子RNA配对和转录激活由大多数哺乳动物DNA中都存在的“Alu序列”介导。这革新了Alu序列“无用”的传统观点。
这两项研究成果先后于2020年、2023年发表于《自然》。
非编码RNA往往与RNA结合蛋白相互作用以形成复杂的高级结构,进而发挥调控功能。在RNA-蛋白质互作位点鉴定方面,科研团队开发了LACE-seq方法,通过线性扩增逆转录酶在RNA结合蛋白(RBP)结合位点处的终止信号,首次实现了在单碱基分辨率和单细胞层面精准鉴定RBP的结合位点。
新冠疫情期间,清华大学生命科学学院副教授张强锋团队为了从RNA结构的角度理解新冠病毒的复制和致病性,利用“icSHAPE”技术,绘制了细胞内新冠病毒全基因组RNA二级结构模型,并利用开发的PrismNet人工智能算法预测了42个可与病毒基因组RNA相互作用的宿主蛋白。
在此基础上,他们发现了一些药物可以通过抑制宿主RNA结合蛋白而影响病毒复制。这些研究工作为新冠防治提供了潜在的靶点和治疗性药物。
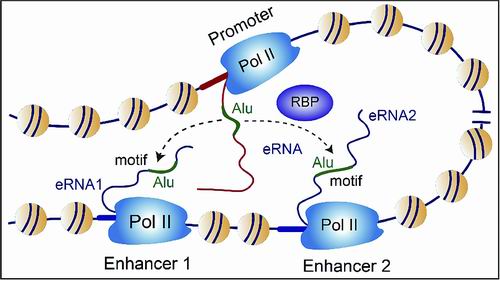 Alu序列介导增强子-启动子RNA配对和转录激活示意图。
Alu序列介导增强子-启动子RNA配对和转录激活示意图。(本版内容由本报记者甘晓、实习生李贺采写,图片由研究团队提供)
陈润生科研RNA论文

 新浪科技公众号
新浪科技公众号 “掌”握科技鲜闻 (微信搜索techsina或扫描左侧二维码关注)
 相关新闻
相关新闻